研究開発
急性腎障害
疾患の特徴
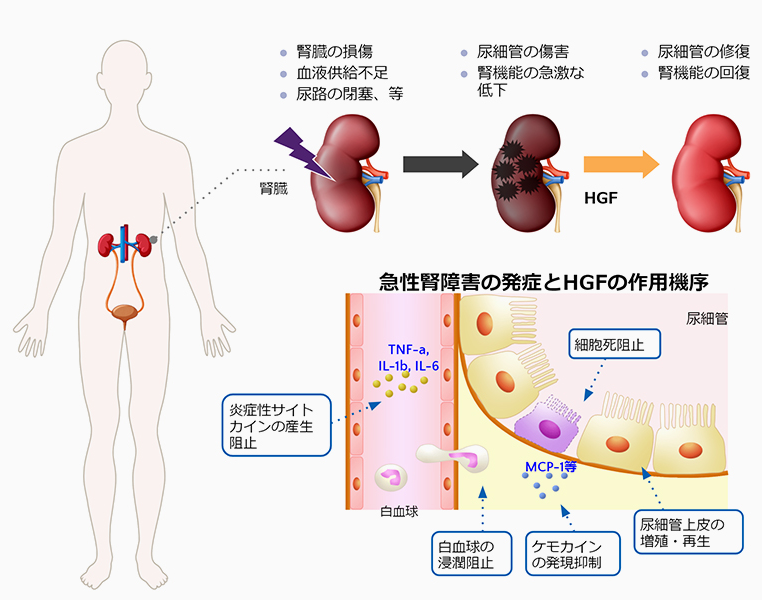
急性腎障害とは、腎臓の損傷、腎臓への血液供給不足、尿路の閉塞等により、数時間~数日という短い期間に急激に腎機能が低下する状態で、その結果、尿を介した老廃物の排泄ができなくなり、体内の水分や塩分量などを調節することができなくなる疾患です。入院患者の5~7%、集中治療室患者の20~25%で発症すると言われており、国内では年間約8万人が発症しています。重篤な場合には救急医療が必要になり、死亡に至る場合も多い疾患です。発症要因が多数あるため、原因を特定できない場合が多く、有効な治療法は確立されていません。
急性腎障害の発症とHGFの作用機序
HGFは、腎臓の細胞に対して保護効果や増殖作用を示すことから、急性腎障害の治療薬となる可能性が考えられます。当社は、米国の腎臓専門クリニック(Rogosin Institute)の協力を得て米国において臨床試験を行いました。ただし、第Ⅰ相試験においては、組換えヒトHGFタンパク質の安全性を確認することが目的であるため、容態の不安定な急性腎障害患者を対象とすることは不適切であると判断し、比較的容態が安定している慢性腎不全患者を対象として試験を実施いたしました。当該試験は、米国食品医薬品局(Food and Drug Administration:以下「FDA」という。)により、必要性の高い新薬の審査を優先的に行う制度であるFast Trackの認定を受けて実施しています。試験結果の概要は、次項目のとおりです。
慢性腎不全患者を対象とした第Ⅰ相試験結果の概要
当該試験において得られた情報を基に、次相試験として急性腎障害患者を対象とした臨床試験の計画を策定しています。また、国内での臨床試験実施を想定した第I相試験の追加試験(日本人での最大耐用量を確認する小規模試験)についても同時に策定しています。具体的には、急性腎障害患者を対象とした治験実施計画書の作成のため、医学専門家へのヒアリング、他社治験例の検討、バイオマーカー調査等の検討を継続しています。しかしながら、次相試験は比較的大規模なプラセボ対照二重盲検比較試験になることが想定されており、現状では当社単独で神経系の治験と並行しての開発継続は難しいと判断し、製薬企業等と提携し、開発資金を確保した上で開発を進める方針としています。
なお、静脈内投与は最も全身性に被験薬が到達するため、安全性の問題も発生しやすい投与経路になります。当該試験において安全性が確認されたことで、他の投与経路の開発を進める上で重要な知見が得られたと考えています。静脈内投与は様々な疾患に適応拡大しやすい投与経路であることから、急性腎障害に限らず、安全性及び有効性が効果的に確認できる疾患を策定しながら開発を進める方針です。
| デザイン | 第Ⅰa相:オープンラベル、用量漸増試験(全9例) 第Ⅰb相:プラセボ対照二重盲検試験(全15例) |
|
|---|---|---|
| 患者母集団 | 18歳以上85歳以下の慢性腎不全患者 | |
| 用法用量 | 第Ia相:3用量、静脈内単回投与 第Ib相:2用量、1回/日、5回、静脈内反復投与 |
|
| 主要評価項目 | 評価基準 | 安全性及び忍容性 |
| 結果 | 重篤な副作用はなかった | |
| 副次評価項目 | 評価基準 | 薬物動態の解析 |
| 結果 | 単回投与で投与後速やかに消失し、反復投与で蓄積性は見られなかった | |
参考文献
- Matsumoto K, Nakamura T. Hepatocyte growth factor: renotropic role and potential therapeutics for renal diseases. Kidney Int. 2001;59(6):2023-2038
- Kawaida K, Matsumoto K, Shimazu H, Nakamura T. Hepatocyte growth factor revents acute renal failure and accelerates renal regeneration in mice. Proc Natl Acad Sci USA. 1994;91:4357-4361.