研究開発
脊髄損傷急性期
疾患の特徴
脊髄とは、脳と体をつなぐ神経が集積している組織であり、脊椎と呼ばれる骨の中に保護されています。脊髄損傷とは、事故や転倒により脊髄に強い外力が加わり、組織が損傷を受けた結果、運動神経や感覚神経の機能が失われ、運動障害や感覚障害を発症する疾患です。
国内では、年間約5千人の新規患者が発生すると報告されています。しかしながらこれまでのところ、損傷した脊髄に対する有効な治療法はなく、脊髄を囲む脊椎の骨折や脱臼を治療するための手術や、リハビリテーションによる残存神経機能の有効利用と日常生活動作の獲得など、対症療法のみとなっています。
- 事故・転倒などで脊髄が損傷
ー新規患者*: 5千人/年 (日本)、6万人/年 (全世界) - 運動神経・感覚神経の傷害
- 損傷部位が脳に近いほど広範な麻痺
- 薬剤・手術などによる根本的治療法はない
ー各種細胞治療は亜急性期
ー鎮痛剤、抗炎症剤等の対症療法のみ - リハビリテーション: 長期入院可能な施設は少ない
- 大きな医療経済効果 (患者さん及び介護者)
※出典:坂井宏旭ら「わが国における脊髄損傷の現状」(2010)、National Spinal Cord Injury Statistical Center, Facts and Figures at a Glance (2019) 及び総務省統計局「世界人口の推移」を基に当社推計
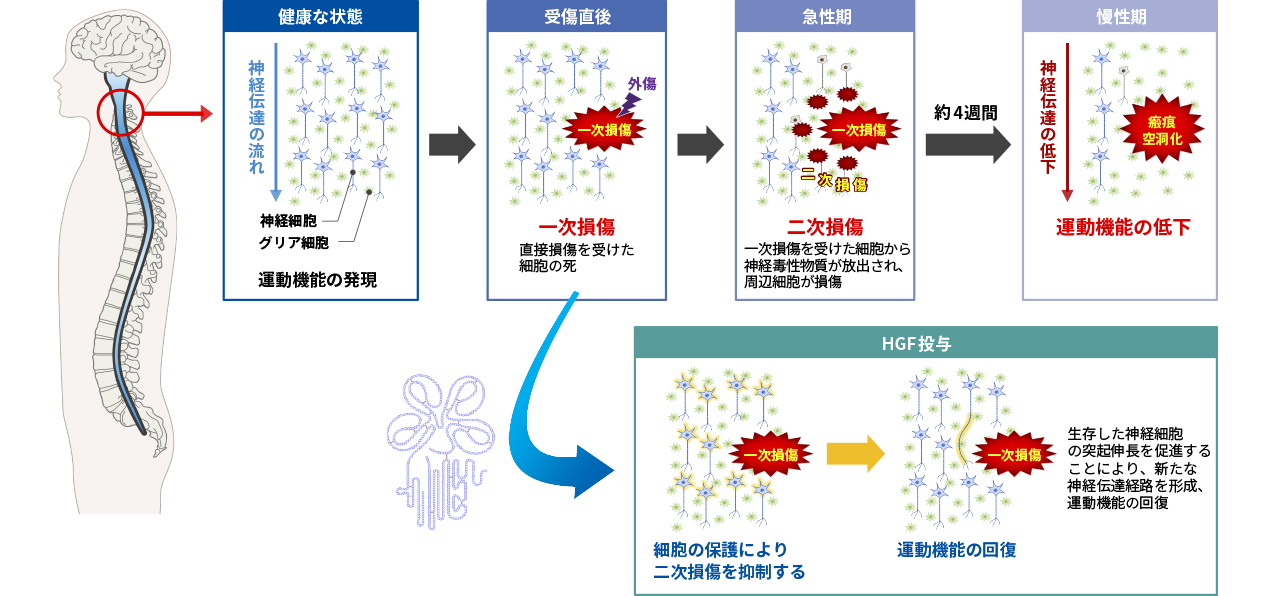
脊髄損傷の発症メカニズムとHGFによる治療効果
HGFは神経細胞に対し保護作用を示すこと、軸索伸展の促進作用があることから、脊髄損傷の新たな治療薬になる可能性があると考えられます。脊髄損傷は外力によって引き起こされる組織の損傷(一次損傷という)に続いて周辺組織に損傷が広がる二次損傷が起こります。脊髄損傷の急性期においては、この二次損傷を抑えることが治療につながると考えられています。
当社では、慶應義塾大学医学部生理学及び整形外科学との共同研究により、脊髄損傷モデル動物を用いて組換えヒトHGFタンパク質の薬理効果を確認する試験を実施したところ、運動機能評価において有効性が確認されました。そこで、医薬品の開発に必要な非臨床試験(毒性試験、薬物動態試験など)を実施して、臨床試験に開発ステージを進めました。脊髄損傷急性期患者を対象とした第Ⅰ/Ⅱ相試験結果の概要は、次項目のとおりです。
脊髄損傷急性期 第Ⅰ/Ⅱ相試験の結果
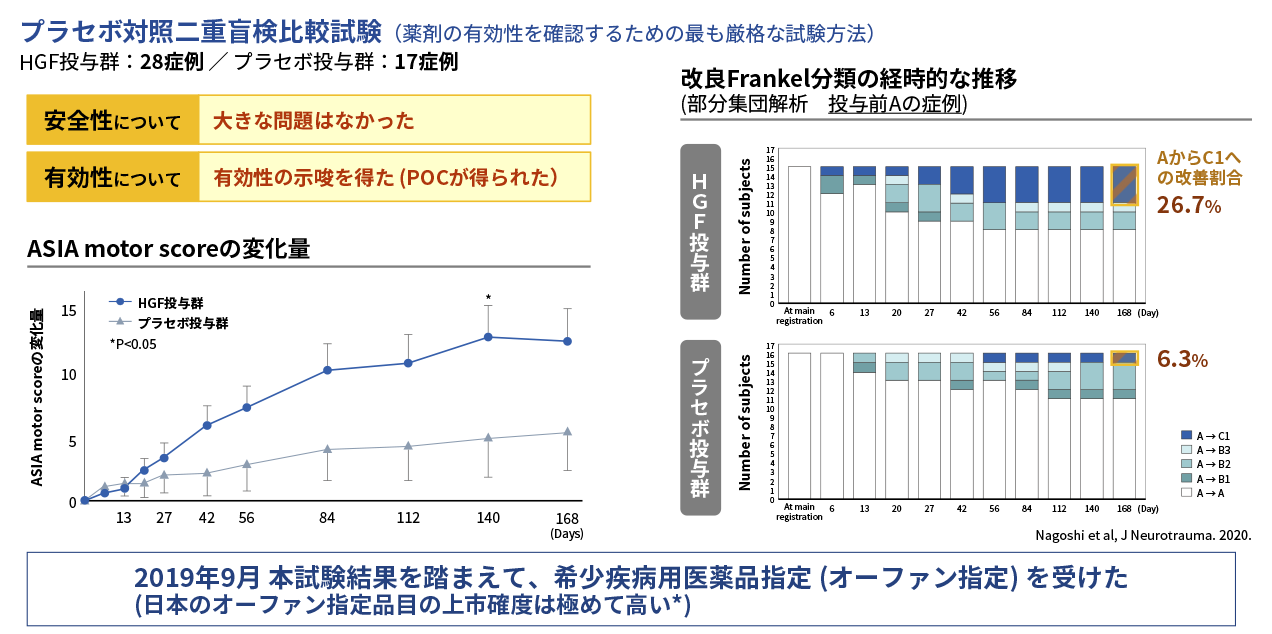
第Ⅰ/Ⅱ相試験は、重度の頚髄損傷急性期患者(改良Frankel分類のA、B1及びB2)45症例を対象に、HGFタンパク質製剤(KP-100IT)の安全性及び有効性の確認を目的とした多施設共同プラセボ対照二重盲検比較試験として実施されました。KP-100ITもしくはプラセボを脊髄腔内に投与し(週1回×5回)、受傷後6か月まで経過観察を行いました。主要評価項目であるASIA motor scoreの受傷後24週時点(Day 168)の変化量は、KP-100IT群とプラセボ群の間で統計的な有意差は認められませんでした。一方、副次評価項目では、ASIA motor scoreの経時的な推移に、プラセボ群に対するKP-100IT群の一貫した差を認め、受傷後20週時点(Day 140)では有意差を認めました。さらに、治験参加時に改良Frankel分類Aの完全麻痺であった患者が観察終了時に運動不全のC1まで改善した割合は、KP-100IT群で26.7%(4/15例)、プラセボ群で6.3%(1/16例)であり、KP-100IT群で改善効果が示されました。本試験の結果は、国際医学雑誌Journal of Neurotraumaに論文発表されています(Nagoshi et al, 2020.)。
※出典:日本の希少疾病用医薬品の指定要件の現状に関する研究 医薬産業政策研究所 リサーチペーパー・シリーズNo.70(2017)
脊髄損傷急性期 第Ⅲ相試験(医薬品開発の最終段階)
第Ⅰ/Ⅱ相試験の結果に基づき、2019年9月に希少疾病用医薬品指定(オーファン指定)を受け、自社で第Ⅲ相試験を開始しました。第Ⅲ相試験は、重度の頚髄損傷急性期患者(AIS分類:A)25症例を対象とする多施設共同非ランダム化試験(全症例にKP-100ITを投与する試験)です。用法用量は第Ⅰ/Ⅱ相試験と同じとし、主要評価項目は治験薬投与後6か月時点のAISがC以上に改善した症例割合としました。第Ⅲ相試験は2020年7月より患者組入れを開始し、2023年4月に組入れを終了いたしました。
| 試験デザイン | 多施設共同非ランダム化試験 |
|---|---|
| 目標症例数 | 26症例 (うち有効性の評価対象は25例) |
| 対象患者 | 頚髄損傷 (AIS分類:A)、年齢:18~89歳 |
| 用法 | 脊髄腔内投与 (週1回×5回) 、観察期間6か月 |
| 主要評価項目 | 治験薬投与後6か月のAISがC以上に改善した症例割合 |
| 実施施設 | 国内5か所 |

脊髄損傷急性期 第Ⅲ相試験 -まとめと今後の方針-
第Ⅲ相試験結果のまとめ
- 有効性について:主要評価項目であるAIS C以上への改善については有意差がなかった。一方、AIS B以上への改善については有意差が認められた。
- 安全性について:安全性・忍容性が確認された。
- コロナ禍の影響により、第Ⅲ相試験の患者背景は第Ⅰ/Ⅱ相試験とは異なっていたと考えられる。これが第Ⅰ/Ⅱ相試験結果との差異要因ではないかと推測された。
今後、患者背景の差異を考慮して更なる層別解析を実施する。
当社の見解
- 第Ⅲ相試験によって、安全性と共に有効性は検証できた。
今後の方針
- PMDAと製造販売承認申請について協議を行う。
- 製造販売承認申請に向けた準備を継続する。
脊髄損傷急性期 薬事承認後のサプライチェーン
脊髄損傷急性期に関しては、第Ⅲ相試験終了後、自社で製造販売承認を申請・取得する予定です。薬事承認取得後の国内のサプライチェーンは、製薬企業及び医薬品卸企業との提携により構築いたします。すなわち、当社が製造販売元となり、丸石製薬株式会社が販売元並びにプロモーション活動、東邦ホールディングス株式会社が全国の救急病院への卸売流通を担うことになっています。当社は、丸石製薬株式会社より製品供給収入に加えて、マイルストーン収入、ロイヤリティ収入を得ることになっています。
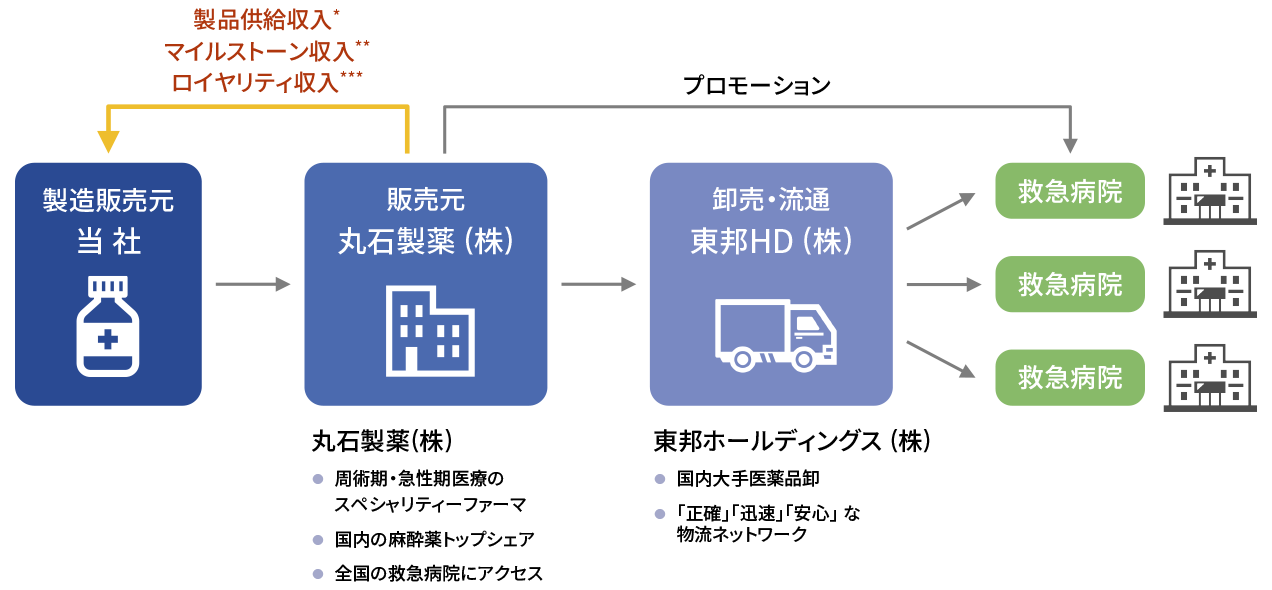
-
- *
- 薬価に一定率を乗じた単価で販売
-
- **
- 開発マイルストーン収入 (製造販売承認申請時、薬価収載時 (先駆的医薬品指定制度の対象品目に指定された場合は一部を先行して受領) 及び適応追加承認時)、販売マイルストーン収入 (売上が年間で一定額を達成した時)
-
- ***
- 販売開始後、年間売上に一定の料率を掛けた金額
用語解説・参考文献
用語解説
| 用語 | 意味・内容 |
|---|---|
| 改良Frankel分類 | 四肢麻痺の機能障害を5段階に分類したFrankel分類を、さらに予後の違いから細分化したもの。完全麻痺のAから正常のEまで11段階に分類される。 |
| ASIA motor score | 米国脊髄障害学会による運動機能を評価する指標で、上肢(50点)と下肢(50点)の運動機能スコアの合計(100点)で構成される。脊髄の各部位に関連した主要筋肉が動くかどうかを点数化したもの。実施が容易で再現性が高いことなどを理由に広く普及している脊髄損傷急性期の評価項目。 |
| AIS | ASIA impairment scale、米国脊髄障害学会が定めた脊髄損傷の機能障害尺度。最も重度の完全麻痺のAから正常のEまで5段階に分類される。 |
参考文献
- Kitamura K, Iwanami A, Nakamura M, et al. Hepatocyte growth factor promotes endogenous repair and functional recovery after spinal cord injury. J Neurosci Res 2007; 85:2332-2342.
- Kitamura K, Fujiyoshi K, Yamane J, Toyota F, Hikishima K, Nomura T, Funakoshi H, Nakamura T, Aoki M, Toyama Y, Okano H, Nakamura M. Human hepatocyte growth factor promotes functional recovery in primates after spinal cord injury. PLoS One. 2011; 6: e27706.
- Kitamura K, Nagoshi N, Tsuji O, Matsumoto M, Okano H, Nakamura M. Application of Hepatocyte Growth Factor for Acute Spinal Cord Injury: The Road from Basic Studies to Human Treatment. Int J Mol Sci. 2019 Feb 28;20(5):1054.
- Nagoshi N, Tsuji O, Kitamura K, Suda K, Maeda T, Yato Y, Abe T, Hayata D, Matsumoto M, Okano H, Nakamura M. A phase I/II study for intrathecal administration of recombinant human hepatocyte growth factor in patients with acute spinal cord injury: a double-blind, randomized clinical trial of safety and efficacy.. J Neurotrauma. 2020 Apr 23. doi: 10.1089/neu.2019.6854.